吸光度法によるタンパク質定量法の選択方法と原理
各測定方法と利点・欠点
| BCA Protein Assay 還元剤前処理タイプ |
BCA Protein Assay | Bradford Protein Assay | Lowry Protein Assay | |
|---|---|---|---|---|
| 定量範囲 | 20-2,000 μg/mL | 5-2,000 μg/mL | 1-1,500 μg/mL | 200-1,500 μg/mL |
| 検出波長 | 562 nm | 562 nm | 595 nm | 750 nm |
| 操作性 | 煩雑 | 普通 | 簡易 | 煩雑 |
| タンパク質間の発色誤差 | 小さい | 小さい | とても大きい | 大きい |
| メリット | 界面活性剤に強い 還元剤に強い |
界面活性剤に強い | 還元剤に強い | ― |
| デメリット | 通常のBCAより 感度が下がる |
還元剤に弱い | 界面活性剤に弱い | 界面活性剤に弱い |
BCA Protein Assayの原理
BCA Protein Assayの原理
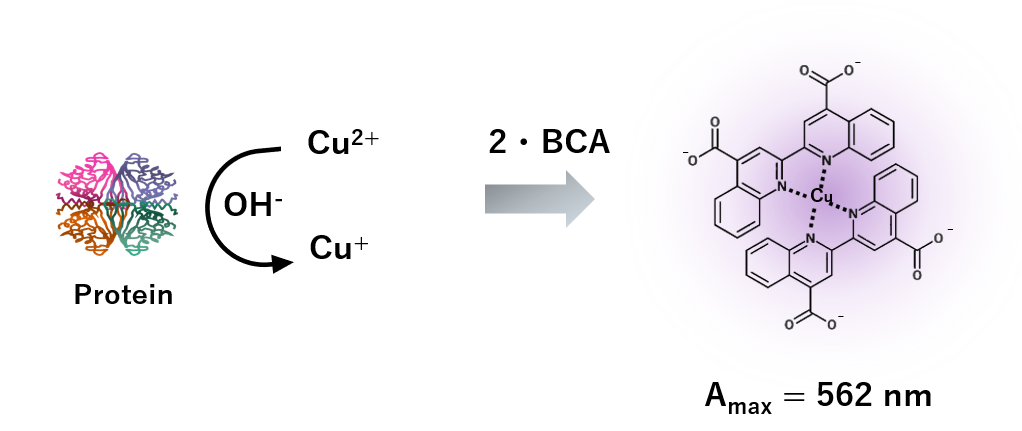
BCAアッセイとはビシンコニン酸(BCA)が錯体形成によって着色する仕組みを利用したタンパク質定量手法です。 塩基性条件下においてタンパク質と2価銅イオンを混合するとタンパク質のペプチド結合が2価銅イオンを1価銅イオンに還元します(この反応をビウレット反応といいます:Biuret test)。 この1価銅イオンは2分子のBCAと錯体を形成します。BCA-Cu錯体は562 nmに吸収を持つため、濃度既知のタンパク質溶液から作成した検量線を用いてタンパク質濃度を定量することができます。
参考文献:Anal Biochem. 1985 Oct;150(1):76-85. doi: 10.1016/0003-2697(85)90442-7.
BCA Protein Assay 還元剤前処理タイプの原理
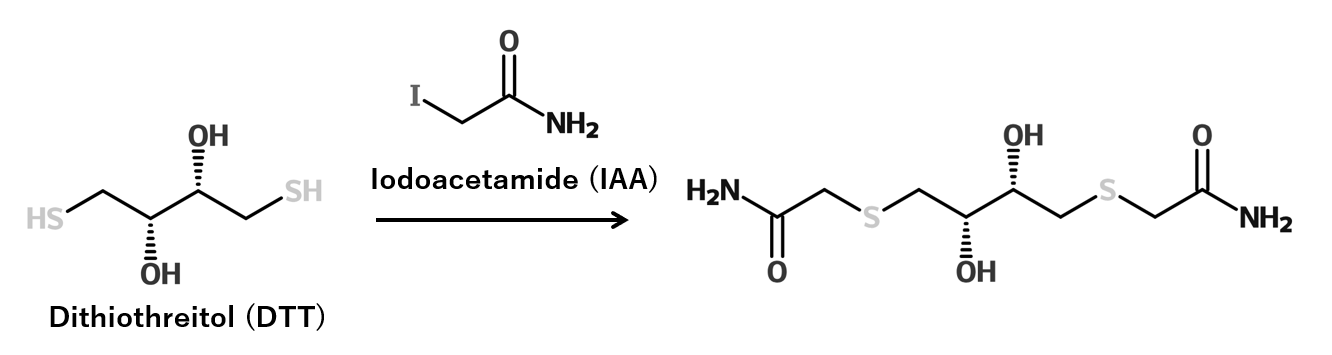
BCAは銅の還元を利用した反応であるため、還元剤に対する許容濃度が低い欠点があります。そのため、測定試料中の還元剤をあらかじめクエンチすることで、還元剤共存サンプルの測定が可能になります。
DTTを例にした場合、ヨードアセトアミドによるチオールのアルキル化によってDTTの還元能を消失させ、BCAタンパク質アッセイでの測定が可能になります。
参考文献:Anal Biochem. 1988 Apr;170(1):203-8. doi: 10.1016/0003-2697(88)90109-1.
Bradford Protein Assayの原理
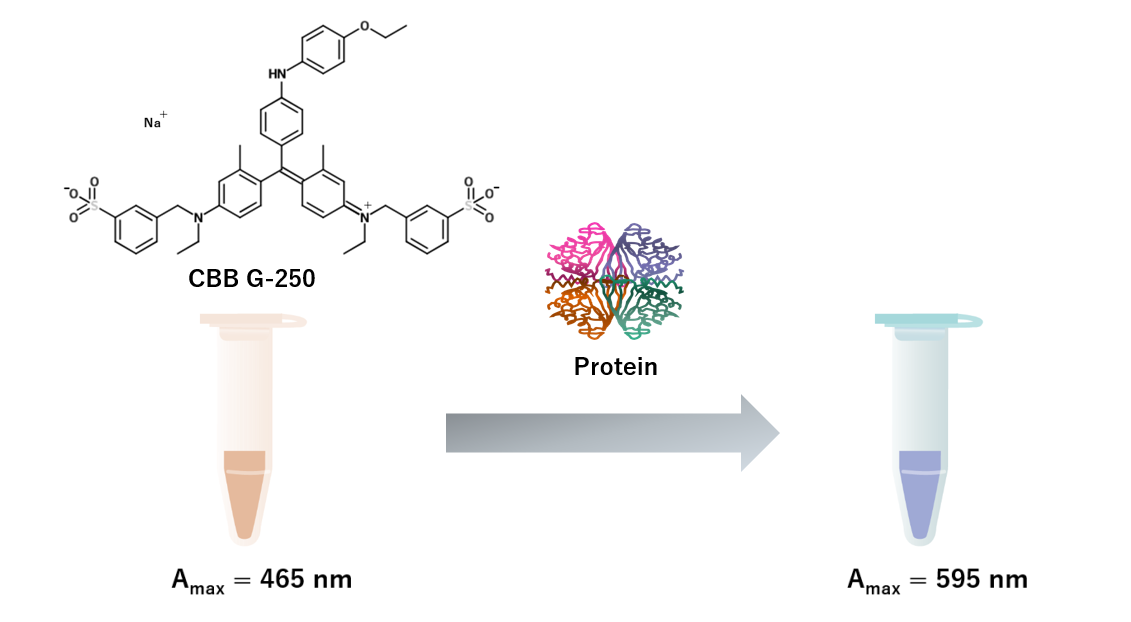
Bradfordアッセイとは Coomassie Brilliant Blue G-250(CBB G-250)がタンパク質への吸着によって色調が変化する仕組みを利用したタンパク質定量手法です。
酸性条件下においてCBBは塩基性アミノ酸残基、N末端アミン、芳香族アミノ酸と結合します。
この結合によってCBBの吸収極大は465 nmから595 nmに変化します。
従って、595 nmの吸光度を測定することで、タンパク質量を測定することができます。
参考文献:Anal Biochem. 1976 May 7:72:248-54. doi: 10.1016/0003-2697(76)90527-3.
Lowry Protein Assayの原理
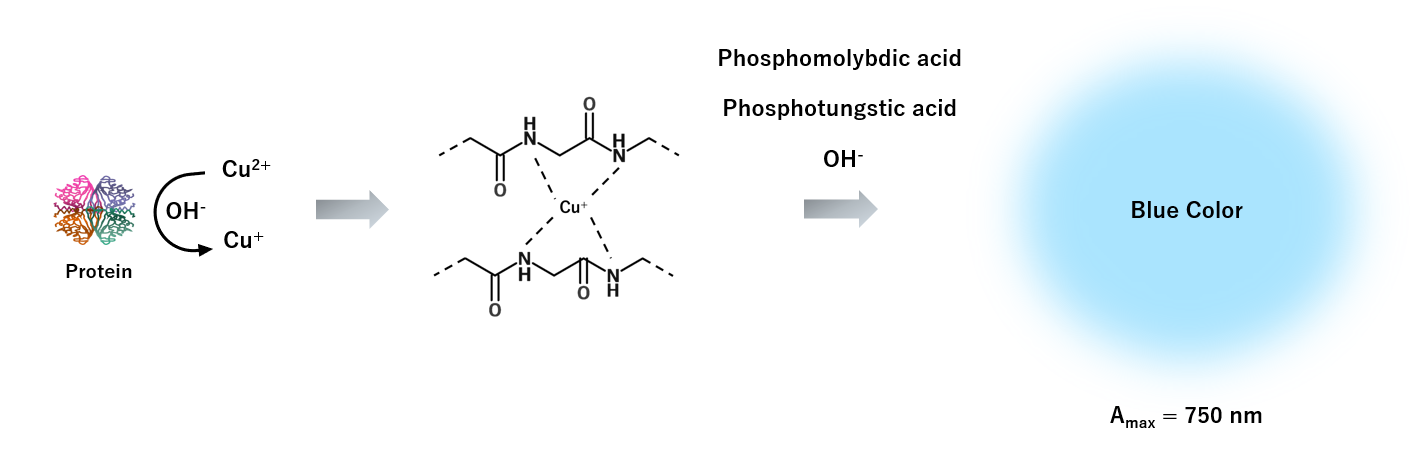
Lowryタンパク質アッセイとはFolin-Ciocalteu 試薬(モリブデン酸/タングステン酸)が着色する仕組みを利用したタンパク質定量手法です。 塩基性条件下においてタンパク質と2価銅イオンを混合するとタンパク質のペプチド結合が2価銅イオンを1価銅イオンに還元します(この反応をビウレット反応といいます:Biuret test)。 この1価銅イオンはタンパク質のペプチド結合のアミンと4座配位複合体を形成します。続いてこの4座配位複合体がFolin-Ciocalteu試薬と反応、または反応を促進すると考えられています。この 反応後の溶液は750 nmに吸収を持つため、濃度既知のタンパク質溶液から作成した検量線を用いてタンパク質濃度を定量することができます。
参考文献:J Biol Chem. 1951 Nov;193(1):265-75.
オススメ!
タンパク質定量試薬の定番品
BCA Protein Assay Kit
オススメ!
任意の抗体で洗浄不要のイムノアッセイを構築できるキット
ONEPot Immunoassay Kit <OpenGUS Method>
…実験お役立ち情報…
実験に役⽴つTIPSや基本情報をご提供します